Hírfolyam
Egy lépéssel közelebb a genetikai betegségek orvoslásához
2022. 05. 19.Genetikai betegségek kialakulásáért felelős RNS módosulások folyamatát elemezték abban a kutatásban, melyben több hazai szakértő, köztük a BME VBK kutatója is részt vett.
Több hazai intézmény különböző szakterületeinek kutatói, biológusok, kémikusok és vegyészek dolgoztak együtt azon a több éve zajló kutatási témán, melynek eredményeként olyan RNS-t módosító folyamatokat tártak fel, melyek felelősek lehetnek genetikai eredetű betegségek kialakulásáért. Ugyanakkor a folyamat összefüggéseinek megértése akár a terápiás eljárásoknál, RNS szerkesztéséhez és génhibákhoz köthető betegségek kezelésekor is sikerrel alkalmazható lehet. A Műegyetem részéről Oláh Julianna, a BME Vegyészmérnöki és Biomérnöki Kar (BME VBK) Szervetlen és Analitikai Kémia Tanszék egyetemi docense vett részt a tudományos munkában, amelynek eredményeit a közelmúltban a szakterület egyik legrangosabb akadémiai folyóiratában, az ACS Catalysis-ban publikálták a kutatásban résztvevő szakemberek.

„A 2015-ben indult intézmények közötti együttműködés résztvevői célul tűzték ki a korábbi, mesterségesen létrehozott fehérjemodell-rendszerek helyett valódi esetekhez, emberekhez köthető biológiai rendszer folyamatainak megértését és feltárását” – ecsetelte a kezdetekről a műegyetemi kutatónő. A tudományos munkában részt vettek az Eötvös Loránd Kutatási Hálózat (ELKH) Természettudományi Kutatóközpontja, az Eötvös Loránd Tudományegyetem (ELTE), a BME és a Semmelweis Egyetem különböző területeken tevékenykedő szakemberei, köztük kémiai számításokkal foglalkozó kutatók.
A jelenlegi kutatás előzményeként az ELTE részéről Karancsiné Menyhárd Dóra, míg a Semmelweis Egyetem oldaláról Tory Kálmán nefrológus azonosították a ritka, ám súlyos, gyermekkorban kezdődő csontvelő-elégtelenséggel párosuló betegség (dyskeratosis congenita, DKC) kórképét: feltáró munkájuk során megtalálták a betegségért felelős fehérjét és annak genetikai kódját.
A genetikai információk dekódolásában fontos szerepet töltenek be a nukleinsavak és azok módosulásai. Míg a DNS-alapú genetikai módosulások területe népszerű kutatási téma, addig az RNS-alapú ún. epitranszkriptomikus eltérések biológiai szerepének jelentőségére csak az utóbbi néhány évben világítottak rá a kutatók. A magyar szakemberek nemrég publikált tudományos összefoglalójukban a hibás RNS-alapú transzformációk következtében létrejött betegségek terápiás lehetőségeire hívták fel a figyelmet.
A kutatásban résztvevő szakemberek górcső alá vették a pszeudouridin-szintázt, azaz, egy olyan enzimet, amely az RNS uridin bázisát pszeudouridinná alakítja, vagyis elhasítja (felbontja) a cukor és a bázis közötti kötést az RNS-ben. Az uridin-pszeudouridin transzformáció az RNS leggyakoribb módosulása a DNS-ről való átíródás után, emiatt a pszeudouridint az ötödik nukleotidként is szokták emlegetni. Az átalakulási folyamatot egy nagyméretű fehérje-RNS komplex, a box H/ACA pszeudouridin szintáz katalizálja. Az RNS-ben eredetileg a cukor a bázis nitrogénatomjához kapcsolódik, ám a végbement folyamat a bázist elforgatva annak már egy szénatomját köti a cukorhoz. A DKC betegség jellegzetessége, hogy a pszeudouridin szintáz helytelen működése miatt nem történik meg az uridinből pszeudouridinné alakulás, vagyis a komplex fehérjealkotók mutációja figyelhető meg a kór egyik ismérveként. A kutatók a „hiányzó” folyamat okaira kerestek magyarázatot.
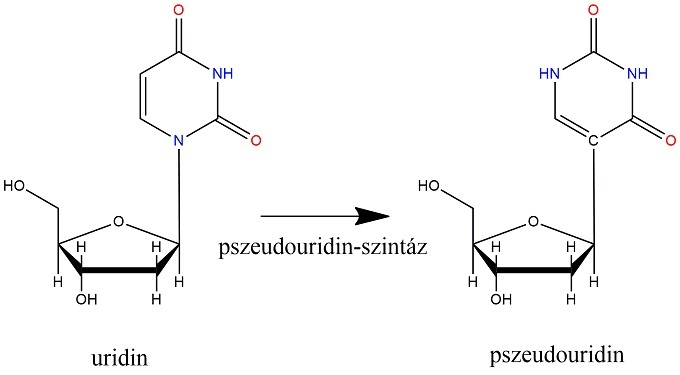
Az uridin és pszeudouridin szerkezete
A téma felderítését célul kitűző szakemberek megépítették a pszeudouridin szintáz komplex modelljét, majd nagy számítási kapacitással párosuló szimulációkban pedig azonosították az atomok pontos helyzetét, az elhelyezkedések és a kölcsönhatások változásait, valamint a kémiai kötések átalakulásának mechanizmusát az uridin pszeudouridinné való transzformációja során. A kutatáshoz szükséges számítások és a modellezés folyamatának megalkotásában vett részt Oláh Julianna, aki a Műegyetemet is képviselte a projektben.
„Sokféle, már létező számításos kémiai módszer egyedi kombinációját használtuk fel, mire sikerült pontosan leképeznünk a pszeudouridin szintáz komplex modelljét. Nagy fába vágtuk a fejszénket, ugyanis ez egy komplex, nagyméretű rendszer, amelyben számos elágazási lehetőséget is számításba kellett venni. Kevés előzetes információnk volt a rendszer egészéről, ezért első lépésben a fehérjeszerkezet egyes darabjait tártuk fel részleteiben, majd e részek ismeretében építettük fel az egészre vonatkozó modellt, amelyet a továbbiakban molekuladinamikai számításokkal, kvantumkémiai módszerekkel és többféle hibrid QM/MM módszerrel is vizsgáltunk” – ecsetelte a tudományos kihívás részleteit a VBK kutatónője.
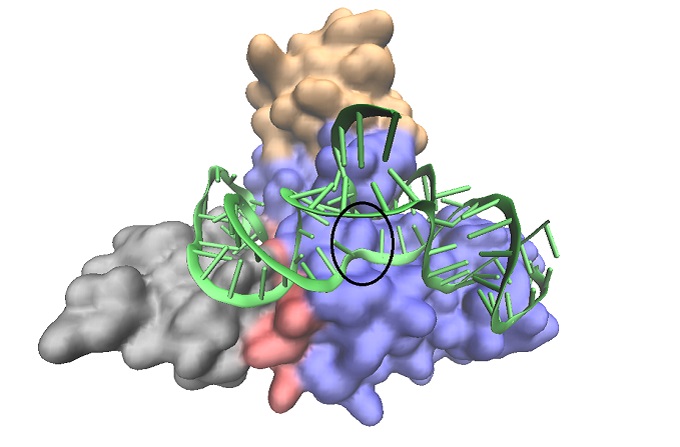
A pszeudouridin-szintáz felépítése. A fehérje komponenseket az alegységek szerint színezett felület jelöli. Az RNS láncok zöldek, az uridin-pszeudouridin átalakulás hozzávetőleges helye bekarikázva látható.
„A modell részleteinek megismerésével, a folyamatok tisztán látásával nemcsak a betegség ok-okozati összefüggéseit ismertük meg jobban, hanem egy lépéssel közelebb kerültünk a lehetséges gyógymódhoz is, ugyanis az enzim működésének részletei ismeretében idővel akár gyógyszeres terápia is tervezhető lesz a kezelés részeként” – hangsúlyozta a kutatás jelentőségét Oláh Julianna. Hozzátette, hogy a Műegyetemen végzett vizsgálatok világítottak rá arra, hogy uridin-pszeudouridin transzformáció egy szekvencia-független átalakulás, vagyis bármilyen uridinnal végrehajtható. Ez a megállapítás a jövőben alapja lehet egy olyan génmódosításnak, amelyben a hibás gént „javítva” orvosolják ezt a ritka betegséget.
Az intézmények közötti összefogást és a kutatást az Országos Tudományos Kutatási Alapprogramok (OTKA) és a Nemzeti Kutatási és Innovációs Alap, a CELSA, a HunProtExc és a MedinProt programok támogatták. A számítási kapacitást a Kormányzati Informatikai Fejlesztési Ügynökség (KIFÜ) HPC infrastruktúrája biztosította.
Oláh Julianna a bme.hu-nak adott interjúban elárulta, hogy komoly, a világon szinte egyedülálló eredményre jutott kutatótársaival: más, valódi biológiai rendszer magyar kutatókéhoz hasonló mély feltárásáról egyelőre nincs tudomásuk a szakembereknek. A műegyetemi kutatónő egyelőre nem tervez további számításokat a pszeudouridin szintázon. „Most sokkal inkább a kísérleti munkáé a főszerep, melynek célja, hogy feltárja, hogyan lehet valódi, gyakorlatban is használható génszerkesztő módszert megalkotni.” Oláh Julianna elárulta azt is, hogy folytatja megkezdett együttműködését az ELTE részéről Karancsiné Menyhárd Dórával, akivel a HunProtExc program keretében további fehérjék vizsgálatával foglalkoznak.
TZS-HA
Fotók forrása: Oláh Julianna, Philip János
